微生物発酵由来
非動物由来原料
乳酸菌の一種である"Streptococcus zooepidemicus"
由来の細胞外高分子物質であり、非動物由来です。
日本薬局方適合

乳酸菌の一種である"Streptococcus zooepidemicus"
由来の細胞外高分子物質であり、非動物由来です。

高純度精製技術により、PMDA(医薬品医療機器総合機構)から一般医薬品の承認を受けています。

厳格な品質管理システムにより、以下へ適合
日本薬局方に基づいて認められたGMP管理
ICH(医薬品規制調和国際会議)のICH-Q7(原薬GMPガイドライン)
| 日本 : |
GMP認証 [12AZ200052]
マスターファイル [217MF10551] |
|---|---|
| US : | Drug Master File for US FDA [12674] |
| EU : | Certificate of Suitability to the European Pharmacopoeia [R0-CEP 2016-247-Rev 00] |
| Korea : | Drug Master File [20180102-96-E-137-42] |
| India : | API Registration Certificate No. RC/BD-002305 |
日本、ヨーロッパ、イギリス、韓国の
薬局方の公定規格に準拠しています。
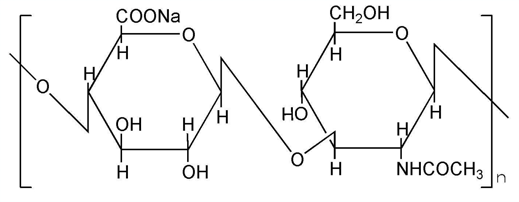
| 日本薬局方 | 精製ヒアルロン酸ナトリウム |
| European Pharmacopoeia | Sodium Hyaluronate |
| British Pharmacopoeia | Sodium Hyaluronate |
| Korean Pharmacopoeia | Sodium Hyaluronate |

下記対象製品は、JMA(JAPAN MUSLIM ASSOCIATION)のHALAL認証を取付ています。
変形性関節症
関節リウマチ
骨再生治療
しわ伸ばし剤
輪郭形成
ボディライン形成
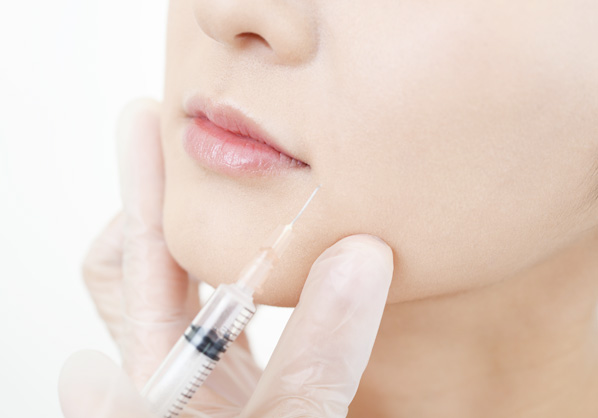
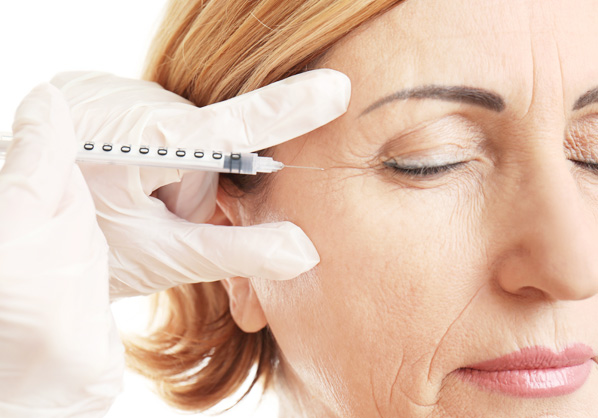
眼粘弾剤
目薬
コンタクトレンズ ケア用品
白内障
眼内レンズ挿入術
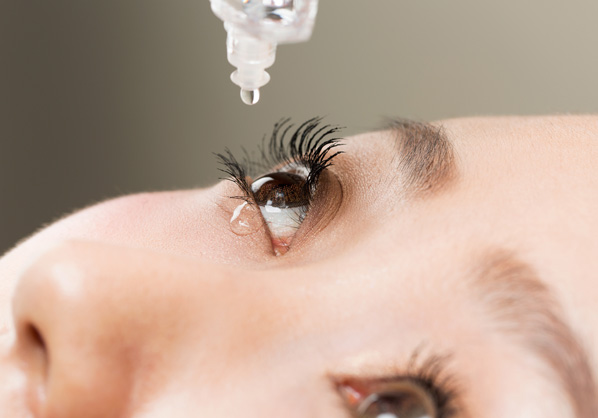

外用スキンケア
皮膚外用剤
皮膚創傷剤
医療機器コーティング剤
癒着防止剤
膀胱尿管逆流症治療
大腸粘膜切除術(EMR)